Piricularia en trigo - INIA informa sobre la presencia de piricularia en el litoral norte de Uruguay en cultivos de trigo en la zafra 2023 y comparte información y estrategias para prevenir su expansión hacia el sur.
Autores: Silvia Pereyra1, Paula Silva1
Colaboradores: Silvana Gonzalez2, Carlos Rossi2, Fernando Pereira1; Dahiana Bentos1, Néstor Gonzalez1
1 Sistema Agrícola-Ganadero. INIA La Estanzuela. Emails de contacto: spereyra@inia.org.uy mpsilva@inia.org.uy; 2 Unidad de Semillas. INIA La Estanzuela; 3 - 25 de abril, 2024
Introducción
La piricularia o brusone es una enfermedad relativamente nueva en el cultivo de trigo, reportada por primera vez en el año 1985 en el estado de Paraná en Brasil (Igarashi et al., 1986). A partir de ese año se expandió a otros estados productores de trigo en Brasil como Matto Grosso del Sur, San Pablo y Río Grande del Sur y a otros países de América del Sur como Paraguay (Viedma y Morel, 2002) y Bolivia (Barea y Toledo, 1996). Se ha reportado en trigo (Cabrera y Gutierrez, 2007; Perelló et al., 2015) y cebada (Gutierrez y Cundum, 2015) en el norte de Argentina y en cebada en Uruguay (Pereyra et al., 2013). En 2016 se detectó en Bangladesh (Malaker et al., 2016) y en 2017 en Zambia (Tembo et al., 2020), donde se constató su procedencia a partir de semilla de trigo infectada proveniente de Brasil (Islam et al., 2016; Ceresini et al., 2019, Latorre et al., 2023) (Figura 1).
Esta enfermedad es especialmente severa en años cálidos y húmedos y se ha convertido en una amenaza a la expansión del cultivo en regiones tropicales y subtropicales del mundo.
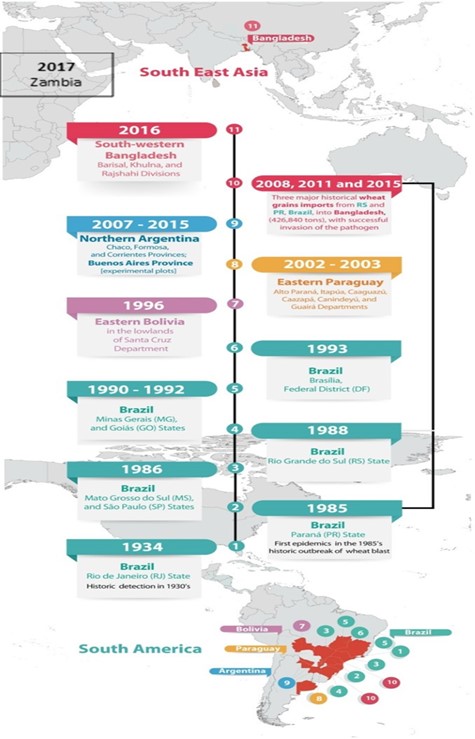
Figura 1. Distribución de brusone o piricularia de trigo al 2022 (modificado de Ceresini et al., 2019)
Importancia económica
Bajo condiciones muy favorables, la piricularia tiene el potencial de producir pérdidas de rendimiento completas, de hasta el 100% en cultivares susceptibles (Duveiller et al., 2016; Cruz and Valent, 2017; Chavez & Kohli, 2018). A su vez, puede afectar la calidad de la semilla y del grano.
Características de la enfermedad
El agente causal es Magnaporthe oryzae (Mo, estado imperfecto Pyricularia oryzae), una especie única con la habilidad de infectar más de 50 especies (Valent et al., 2020). Existen varios linajes o patotipos dentro de la especie M. oryzae, siendo algunos de ellos: Mo patotipo Triticum (MoT), Mo patotipo Lolium (MoL), y Mo patotipo Oryzae (MoO), específicos a sus huéspedes, trigo, raigras, y arroz, respectivamente (Tosa et al., 2004). Sin embargo, puede existir cierto grado de infección cruzada entre algunos de ellos. Existen herramientas biotecnológicas, como los marcadores moleculares que permiten la identificación del patotipo de Mo. Para diagnóstico del patotipo MoT se utiliza el marcador MoT3 (Pieck et al., 2017) que es específico para éste y permite diferenciarlo de otros. También se han desarrollado herramientas de diagnóstico cuanti y cualitativas del patógeno en semilla (Yasuhara-Bell et al., 2018; Thierry et al., 2020).
Síntomas y epidemiología
El patotipo MoT puede infectar todas las partes aéreas de la planta de trigo, pero el síntoma más común en el campo es el tizón de la espiga (brusone o piricularia) (Cruz & Valent, 2017).
El hongo puede causar síntomas tempranamente a nivel de hoja de ocurrir condiciones predisponentes para la infección y colonización en este órgano, sin embargo, el periodo más susceptible ocurre a nivel de espiga, (Hossain, 2022). Los síntomas a nivel de hoja son lesiones redondeadas a ovaladas, blancas a grises, con bordes verde oscuro a marrones-rojizos y rodeadas por un halo amarillento. En la espiga el hongo rodea al raquis donde se puede observar una coloración oscura, pardo-grisácea a diferentes niveles y momentos, interrumpiendo la traslocación de nutrientes y provocando la muerte de la parte superior desde donde se produjo la infección. La espiga puede quedar blanca (estéril) en su totalidad, en partes o solo algunas espiguillas (Figura 2).
La infección en la espiga causada por la piricularia se confunde fácilmente con los síntomas causados por la fusariosis de la espiga. Sin embargo, en lugar de infectar a las espiguillas individualmente, la piricularia infecta el raquis. La porción de la espiga encima del punto de infección se seca y no forma granos o se producen granos chuzos, mientras que la porción inferior se mantiene sana y produce granos normales (Singh et al., 2021).
La forma de sobrevivencia de un año a otro es como micelio o esporas (conidios) sobre rastrojos infectados, semillas, plantas voluntarias y eventualmente otros hospederos (Goulart y Paiva, 1990; Urashima et al., 2004; Castroagudín et al., 2017; Chávez y Kohli, 2018). Bajo condiciones ambientales favorables, el hongo puede establecer ciclos de reinfección cada una semana, aproximadamente.
Aunque las semillas pueden diseminar a M. oryzae, se entiende que este no es el factor principal para el desarrollo de una epidemia de importancia (Trevathan et al., 1994). Su mayor relevancia es ser la vía de introducción del patógeno a nuevas chacras o regiones libres del patógeno (Valent et al., 2020; Latorre et al., 2023).

Figura 2. Síntomas de Piricularia del trigo en diferentes partes de la planta. (A) foco inicial en campo, (B) campo infectado mostrando espigas blanqueadas con resto de la planta aun verde, (C) típicas espigas blanqueadas parcial o totalmente en el campo, (D) una espiga parcialmente blanqueada con múltiples puntos de infección, (E) esporulación gris oscuro del hongo MoT en el raquis, (F) aristas infectadas muestran una decoloración de color marrón a blanquecino, (G) glumas infectadas muestran lesiones elípticas con el centro de blanco a marrón y márgenes de color gris oscuro, (H) grano severamente afectado en comparación con grano sano, (I) lesiones típicas en forma de ojo con centros grises o blanquecinos rodeados por márgenes de color marrón oscuro en la hoja de la plántula, (J) campo con plántulas severamente afectadas por una infección por MoT, (K) lesiones típicas con forma de ojo o elípticas en una hoja madura, y (L) lesiones en tallo de forma elípticas o alargadas con centros blancos rodeados por márgenes marrones o negruzcos (tomada de Singh et al., 2021)
Condiciones predisponentes
La enfermedad se desarrolla más favorablemente en condiciones con alta humedad relativa, temperaturas entre 25 a 30°C y un período de mojado foliar y/o de espigas de aproximadamente 10 a 14 horas o más (Martins Nunes & Mittelmann, 2009; Tembo et al., 2020). En estas circunstancias, la enfermedad progresa rápidamente y las lesiones son visibles alrededor de los cinco días después de la infección.
Las epidemias de piricularia en trigo se reportan luego de 15 días de lluvias continuas y temperaturas de 18 a 25 °C durante la espigazón-floración (Kohli et al., 2011). Cabe destacar que el momento más crítico de la enfermedad ocurre durante el embuche y emisión de espigas.
Fertilizaciones nitrogenadas altas que provoquen desbalances nutricionales en las plantas también favorecen el desarrollo de la enfermedad (Lobo et al., 2012).
Antecedentes de la enfermedad en Uruguay
La piricularia es una enfermedad relevante en arroz, causada por Mo patotipo Oryzae (no afecta trigo), en raigrás causada por Mo (Martinez & Escalante, 2016) patotipo Lolium (Rahnama et al., 2023). Ha sido esporádicamente encontrada en hojas y granos de cebada (1999, 2013, Pereyra et al., 2013).
Relevamiento en Uruguay - 2023
Dadas las condiciones predisponentes para piricularia en trigo en Brasil, Paraguay y Bolivia en la presente zafra, y las condiciones climáticas prevalentes en el norte de la zona triguera del litoral (Departamentos de Salto y Artigas, Figura 3), se relevaron 11 chacras comerciales y/o sitios experimentales en el litoral norte. Se colectaron un total de 17 muestras de espiga del 10/10/2023 al 12/10/2023 (Figura 3).
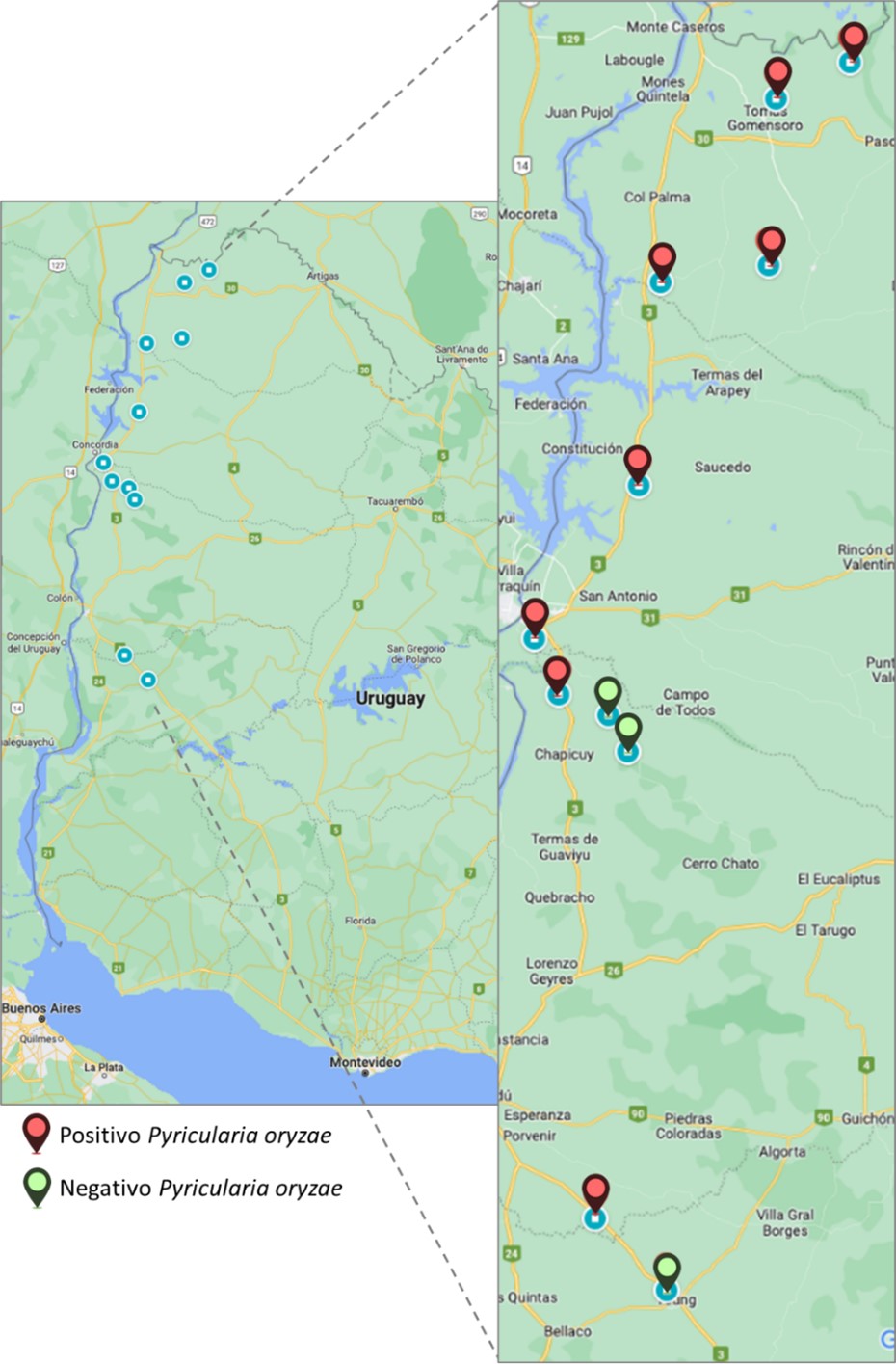
Figura 3. Mapa de los sitios donde se colectaron muestras de espigas de trigo. Se identifica en cada punto si la muestra colectada resultó positiva (marca roja) o negativa (marca verde) para Magnaporthe (Pyricularia) oryzae
El diagnóstico de las muestras colectadas se realizó en el laboratorio de fitopatología de INIA La Estanzuela mediante plaqueo, incubación y posterior observación bajo lupa y microscopio e identificación por morfología de conidias (Figura 4). Del total de 17 muestras colectadas, 9 resultaron positivas para piricularia. Cabe resaltar que casi la totalidad de las muestras positivas provinieron de los departamentos de Artigas y Salto. Actualmente se está en fase de obtención de aislados puros a partir de estas muestras en medio de cultivo para poder realizar la correspondiente caracterización morfológica y molecular con el fin de identificar si las infecciones fueron causadas por Mo patotipo Triticum -u otro patotipo diferente.
En el norte del país, en la segunda década de junio y primera década de julio de 2023 ocurrieron lluvias intermitentes, altas temperaturas y humedad relativa que podrían indicar condiciones predisponentes para el inicio de la piricularia a nivel de hojas en los cultivos de trigo (Apéndice 1, en resaltado). A esto se sumaron condiciones similares en el periodo de emergencia de espigas y primeras etapas de llenado de grano (Figura 5).
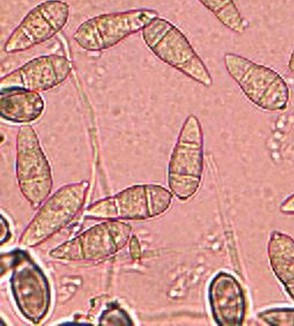
Figura 4. Conidios de Pyricularia oryzae
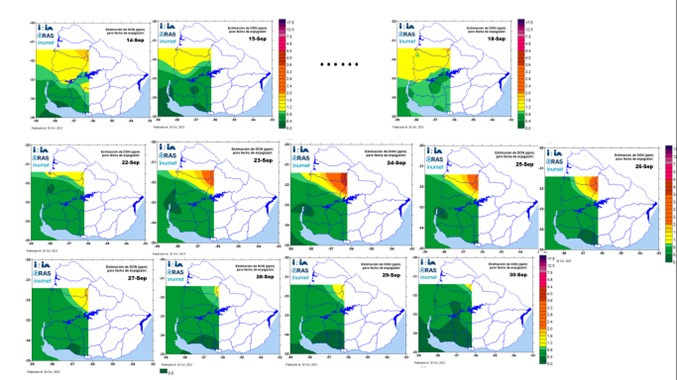
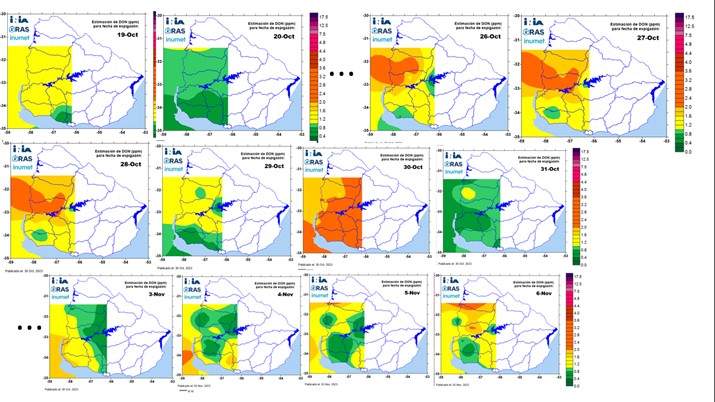
Figura 5. Mapas de riesgo de DON en grano de trigo, asociado a fusariosis de la espiga, en la región triguera de Uruguay, en distintos periodos desde 14 de setiembre a 6 de noviembre de 2023, con condiciones similares a las predisponentes para la infección y desarrollo de piricularia en trigo.
Conclusión
Se ha constatado la ocurrencia de piricularia en chacras de trigo expuestas a condiciones predisponentes a la enfermedad en el norte del Uruguay en la zafra 2023.
Perspectivas y recomendaciones
El trigo se siembra en Uruguay mayormente en zonas no predisponentes para piricularia, con la excepción del área marginal del norte del litoral en donde se constató su presencia en la zafra 2023. En esta región (Artigas y Salto), el área de trigo representa aproximadamente no más del 5%. En este sentido, hasta el momento, es posible establecer que la enfermedad no es endémica en el país.
Por lo tanto, es importante contextualizar lo esporádico de la enfermedad en el norte, coincidente con años en donde ocurren condiciones de alta temperatura y lluvias frecuentes en el sur de Brasil y Paraguay.
Ante esta situación, es importante prevenir la eventual incurrencia hacia el sur en la región triguera nacional, por aumento en frecuencia de condiciones cálidas y lluviosas (ej. cambio climático) y/o ante la eventual adaptación de cepas del hongo a menores temperaturas en alta humedad.
Las siguientes recomendaciones se proponen para su uso en forma integrada con el objetivo de evitar su expansión en el área del cultivo:
A nivel productivo:
- Uso de semilla libre de Magnaporthe oryzae en zonas donde no se ha reportado piricularia
La semilla representa la principal fuente de inóculo en áreas libres de la enfermedad, aunque no constituye el factor determinante para la ocurrencia de epifitias a nivel de chacra en las zonas donde la piricularia ya está presente. Magnaporthe oryzae puede sobrevivir por aproximadamente dos años en la semilla y aun lotes aparentemente sanos, provenientes de chacras infectadas, pueden contener conidios del hongo.
Si bien existen curasemillas con eficiencia intermedia a alta para su control (ej. benomil, carbendazim, tiram, difenoconazol), no se recomienda que el destino de la cosecha de las chacras en la región donde se constató la presencia de piricularia se utilice como semilla fuera de las zonas indicadas como positivas en la Figura 3. Ello podría prevenir su expansión hacia el sur.
Para constatar la presencia de Mo en su semilla, sugerimos remitir muestras a laboratorios de diagnóstico o al Laboratorio de Semillas de INIA La Estanzuela (Contacto: Silvana Gonzalez, sngonzalez@inia.org.uy).
- Uso de cultivares resistentes
La resistencia genética es la mejor estrategia para el control de enfermedades, en tanto no tiene costo adicional para los productores ni un impacto ambiental ya que puede incidir en un menor uso de fungicidas. Solo ocho genes de resistencia han sido descriptos para MoT (Rmg1- Rmg8), y solo Rmg8 aun muestra ser efectivo en controlar MoT (Latorre et al., 2023). Recientemente, se demostró que la translocación 2NVS/2AS introgresada al trigo desde el pariente cercano Aegilops ventricosa confiere resistencia útil, aunque parcial ya que no todos los materiales que poseen el fragmento son resistentes (Cruz et al., 2016; Cruppe et al., 2019). Mas aún, datos preliminares sugieren que la resistencia conferida por 2NVS está siendo superada por aislamientos recientes que muestran una mayor agresividad (Cruppe com. pers., 2020).
A nivel nacional, existe una caracterización de cultivares muy preliminar frente a piricularia realizada fenotípicamente en Paraguay y Brasil; y genotípicamente a través de la predicción de presencia/ausencia del fragmento 2NVS utilizando una metodología bioinformática (Silva et al., 2019). De un total de 3977 líneas de trigo (variedades y líneas avanzadas de mejoramiento), sólo 495 líneas (14,2% del total) resultaron positivas para la presencia de 2NVS, lo que sugiere que el fragmento está presente en una proporción baja.
INIA cuenta con información parcial del comportamiento frente a piricularia para varios cultivares comerciales. Por mayor información, consulte a Paula Silva (mpsilva@inia.org.uy ).
Manejo con fungicidas
La eficacia de los fungicidas para el manejo de piricularia a campo es considerada baja en los países donde esta enfermedad es endémica (ej. Brasil). Las mayores eficiencias se logran con mezclas de triazoles+estrobilurinas o triazoles+estrobilurinas+carboxamidas en inicio de espigazón, en cultivares moderadamente resistentes con presión baja a media de piricularia. Las menores eficiencias de control se deben a la dificultad de llegar a los sitios de infección en las espiguillas, a la continua disponibilidad de inóculo en ambientes altamente predisponentes y eventualmente, al desarrollo de resistencia o menor sensibilidad a los grupos de fungicidas antes mencionados (Ceresini et al., 2018).
Por mayor información consulte a Silvia Pereyra (spereyra@inia.org.uy )
- Adecuar la fecha de siembra del trigo para que la espigazón no coincida con períodos cálidos y lluviosos puede representar otra estrategia de manejo que asista al manejo de la piricularia.
A nivel de la investigación nacional:
- Conducir estudios con el objetivo de estimar y prevenir el riesgo de ocurrencia de piricularia en el área del cultivo de trigo en Uruguay, incluyendo trabajos epidemiológicos, caracterización de la población de M. oryzae en trigo y otros hospederos en los sistemas de producción de trigo, caracterizar el comportamiento de líneas avanzadas del programa de mejoramiento de trigo nacional y de todos los cultivares registrados en el país frente a piricularia en ambientes conducivos de la región, caracterizar genotípicamente a estos cultivares por la presencia/ausencia de genes que confieren resistencia a piricularia. Eventualmente, en función de nivel de riesgo, evaluar curasemillas y fungicidas.
A nivel de extensión-difusión:
- Capacitar a productores y técnicos en el reconocimiento de síntomas y en las medidas de manejo antes mencionadas para minimizar el riesgo de diseminación de la enfermedad más allá del área de ocurrencia.
Ante la sospecha de tener piricularia en su cultivo, remita muestras a laboratorios de diagnóstico o al Laboratorio de Fitopatología de INIA La Estanzuela (Colonia).
Referencias bibliográficas
Barea G, Toledo J. 1996. Identificación y zonificación de Pyricularia o brusone (Pyricularia oryzae) en el cultivo de trigo en el departamento de Santa Cruz. Santa Cruz de la Sierra, Bolivia, pp 76–86
Cabrera M, and Gutierrez S. 2007. Primer registro de Pyricularia grisea en cultivos de trigo del NE de Argentina. Depto. Protección Vegetal, Facultad de Ciencias Agrarias, UNNE. In Actas de la Reunión de Comunicaciones Científicas y Tecnológicas, SGCYT, p. (Abstr.). Universidad Nacional del Nordeste. Corrientes, Argentina.
Castroagudín, V.L., Danelli, A., Moreira, S.I., Reges, J.T.A., Carvalho, G., Maciel, J.L.N., Bonato, A.L.V., Forcelini, C.A., Alves, E., McDonald, B. and Croll, D. 2017. The wheat blast pathogen Pyricularia graminis‐tritici has complex origins and a disease cycle spanning multiple grass hosts. bioRxiv, 203455 Available at: https://doi.org/10.1101/203455
Ceresini PC, Castroagudín VL, Rodrigues FÁ, Rios JA, Aucique-Pérez CE, Moreira SI, Croll D, Alves E, de Carvalho G, Maciel JLN, McDonald BA. 2019. Wheat blast: from its origins in South America to its emergence as a global threat. Mol Plant Pathol. 20:155-172. https://doi.org/10.1111%2Fmpp.12747
Chávez A, Kohli M. M. 2015. Alternative hosts of Magnaporthe grisea of wheat in Paraguay (in Spanish). Investig Agrar 17(1):54–59.
Chavez A, Kohli, M. M. (eds) 2018. Pyricularia de trigo en Paraguay. Compendio de investigación. CAPECO, Asunción. 80p.
Cruppe G, Cruz CD, Peterson GL, Pedley KF, Mohammad A, Fritz A, Calderon L, Lemes da Silva C, Todd T, Kuhnem P, Singh PK, Singh RP, Braun H-J, Barma NCD, Valent B. 2019. Novel Sources of Wheat Head Blast Resistance in Modern Breeding Lines and Wheat Wild Relatives. Plant Disease First Look: https://doi-org.er.lib.k-state.edu/10.1094/PDIS-05-19-0985-RE
Cruz CD, Kiyuna J, Bockus WW, Todd TC, Stack JP, Valent B. 2015. Magnaporthe oryzae conidia on basal wheat leaves as a potential source of wheat blast inoculum. Plant Pathol 64:1491–1514.
Cruz CD, Peterson GL, Bockus WW, Kankanala P, Dubcovsky J, Jordan KW, Akhunov E, Chumley F, Baldelomar FD, Valent B. 2016. The 2NS translocation from Aegilops ventricosa confers resistance to the Triticum Pathotype of Magnaporthe oryzae. Crop Science 56:990-1000.
Cruz, C. D., & Valent, B. 2017. Wheat blast disease: danger on the move. Tropical Plant Pathology, 42, 210-222.
de Coelho MA, Torres M, Cecon PR, Santana FM. 2016. Sowing date reduces the incidence of wheat blast disease. Pesq Agropec Bras 1(5):631–637.
Duveiller, E., He, X., & Singh, P. K. 2016. Wheat blast: An emerging disease in South America potentially threatening wheat production. World wheat book, 3, 1107-1122.
Goulart, A; Paiva, F. 1990. Transmissão de Pyricularia oryzae a traves de sementes de trigo (Triticum aestivum). Fitopatologia Brasileira 15: 359-362.
Gutiérrez SA, Cúndom MA. 2015. Pyricularia oryzae en cultivos de cebada en Corrientes (Argentina). Summa Phytopathol 41:318–320.
Hossain MM (2022) Wheat blast: A review from a genetic and genomic perspective. Front. Microbiol. 13:983243. doi: 10.3389/fmicb.2022.983243
Igarashi S, Utimada C.M, Igarashi LC, Kazuma AE, Lopes RC. 1986. Pyricularia sp. em trigo. I. Occurencia de Pyricularia sp. no estado do Paraná. Fitopatologia Brasileira 11:351-352.
Islam MT, Croll D, Gladieux P, Soanes DM, Persoons A, Bhattacharjee P, Hossain MS, Gupta DR, Rahman MM, Mahboob MG, Cook N, Salam MU, Surovy MZ, Sancho VB, Maciel JLN, Nhani A, Castroagudin VL, Reges JTD, Ceresini PC, Ravel S, Kellner R, Fournier E, Tharreau D, Lebrun MH, McDonald BA, Stitt T, Swan D, Talbot NJ, Saunders DGO, Win J, Kamoun S. 2016. Emergence of wheat blast in Bangladesh was caused by a South American lineage of Magnaporthe oryzae. BMC Biology 14:84.
Kohli, M.M., Mehta, Y.R., Guzman, E., De Viedma, L., and Cubilla, L.E. 2011. Pyricularia blast - a threat to wheat cultivation. Czech Journal of Genetics and Plant Breeding 47, S130-S134.
Latorre, S. M., Were, V. M., Foster, A. J., Langner, T., Malmgren, A., Harant, A., ... & Kamoun, S. 2023. Genomic surveillance uncovers a pandemic clonal lineage of the wheat blast fungus. Plos Biology, 21(4), e3002052.
Lobo, V.L.S.; Filippi, M.C.; Silva, G.B.; Venancio, W.L.; Prabhu, A.S. 2012. Relação entre o teor de clorofila nas folhas e a severidade de brusone nas panículas em arroz de terras altas. Tropical Plant Pathology, 37:83-87.
Malakar PK, Barma NCD, Tiwari TP, Collis WJ, Duveiller E, Singh PK, et al. 2016. First report of wheat blast caused by Magnaporthe oryzae pathotype Triticum in Bangladesh. Plant Disease. 100: 2330 https://doi.org/10.1094/PDIS-05-16-0666-PDN
Martinez, S.; Escalante, F. 2016. La Pyricularia o Brusone en semilleros de Raigrás. Rev. INIA 46:16-19.
Martins Nunes, C. ; Mittelmann, A. 2009. Doenças do azevém. Documentos, 279, Embrapa Clima Temperado, 40 p.
Perelló A, Martinez L, Molina M. 2015. First report of virulence and effects of Magnaporthe oryzae isolates causing wheat blast in Argentina. Plant Dis. 99:1177–1178.
Pereyra S, Stewart S, Germán S. 2013. Report on Magnaporthe sp. in Uruguay. INIA La Estanzuela, April 8th, 2013, p 1
Pieck ML, Ruck A, Farman ML, Peterson GL, Stack JP, Valent B, et al. 2017. Genomics-based marker discovery and diagnostic assay development for wheat blast disease. Plant Dis. 101:103–109 http://dx.doi.org/10.1094/PDIS-04-16-0500-REPMID:30682315
Rahnama, M., Condon, B., Ascari, J.P. et al. 2023. Recent co-evolution of two pandemic plant diseases in a multi-hybrid swarm. Nat Ecol Evol 7:2055–2066. https://doi.org/10.1038/s41559-023-02237-z
Silva, P., Gao, L., Pereyra, S., Lado, B., Germán, S., Quincke, M., Poland, J. 2019. Preparing for the potential emergence of wheat blast in Uruguay. In: International Wheat Congress, Saskatchewan, Canada.
Singh, P. K., Gahtyari, N. C., Roy, C., Roy, K. K., He, X., Tembo, B., et al. 2021. Wheat blast: a disease spreading by intercontinental jumps and its management strategies. Frontiers in Plant Science, 12:1467.
Tembo, B., Mulenga, R. M., Sichilima, S., M'siska, K. K., Mwale, M., Chikoti, P. C., et al. 2020. Detection and characterization of fungus (Magnaporthe oryzae pathotype Triticum) causing wheat blast disease on rain-fed grown wheat (Triticum aestivum L.) in Zambia. PloS one, 15(9), e0238724.
Thierry, M., Chatet, A., Fournier, E., Tharreau, D., Ioos, R. 2020. A PCR, qPCR, and LAMP toolkit for the detection of the wheat blast pathogen in seeds. Plants, 9(2):277.
Tosa, Y., Hirata, K., Tamba, H., et al. 2004. Genetic constitution and pathogenicity of Lolium isolates of Magnaporthe oryzae in comparison with host species-specific pathotypes of the blast fungus. Phytopathology, 94(5):454–462. https://doi.org/10.1094/PHYTO.2004.94.5.454
Urashima, A.S., Lavorent, N.A., Goulart, A.C.P. and Mehta, Y.R. 2004. Resistance spectra of wheat cultivars and virulence diversity of Magnaporthe grisea isolates in Brazil. Fitopatol. Bras. 29: 511–518.
Valent, B., Singh, P. K., He, X., et al. 2020. Chapter 13: Blast Diseases: Evolution and Challenges of a Staple Food Crop Fungal Pathogen. Pages 267-292 in: Emerging Plant Diseases and Global Food Security. J. B. Ristaino and A. Records, eds. American Phytopathological Society Press, St. Paul, MN.
Viedma LQ, Morel W. 2002. Añublo o Pyricularia del Trigo. Díptico. MAG/DIA/ CRIA. Programa de Investigación de Trigo, CRIA, Capitán Miranda, Itapúa.
Yasuhara-Bell, J., Pedley, K. F., Farman, M., Valent, B., & Stack, J. P. 2018. Specific detection of the wheat blast pathogen (Magnaporthe oryzae Triticum) by loop-mediated isothermal amplification. Plant Dis. 102:2550-2559.
